Về pháp lý
Đối với các sáng chế về dược phẩm, việc bảo hộ độc quyền cho phép chủ sở hữu có thể khai thác hợp pháp sáng chế để thu hồi chi phí nghiên cứu đã bỏ ra đồng thời kích thích việc tìm ra các sáng chế mới.Tuy nhiên, việc bảo hộ độc quyền sáng chế dược phẩm cũng có những mặt trái, nhất là nó làm cho giá thuốc chữa bệnh sẽ bị đẩy lên cao, đồng nghĩa với việc hạn chế khả năng tiếp cận của công chúng đối với những sáng chế mới trong lĩnh vực dược phẩm nói chung và các loại thuốc chữa bệnh nói riêng.
Để giải quyết mâu thuẫn này, Hiệp định về các khía cạnh liên quan đến thương mại của quyền sở hữu trí tuệ (“TRIPS”) và Tuyên bố của WTO về TRIPS và Sức khỏe cộng đồng (“Tuyên bố Đô-ha”) đã đưa ra một số biện pháp linh hoạt trong việc bảo hộ sáng chế.

Ảnh minh hoạ
Hiệp định TRIPS
Được các quốc gia thành viên ký kết ngày 15/4/1994 và có hiệu lực từ ngày 01/01/1995, TRIPS là một điều ước quốc tế đa phương bao trùm toàn cầu có vai trò quan trọng hàng đầu về lĩnh vực sở hữu trí tuệ. Các quy định của TRIPS có tính chất ràng buộc về mặt pháp lý đối với tất cả các nước thành viên WTO, trong đó có Việt Nam.
TRIPS quy định các tiêu chuẩn tối thiểu về bảo hộ sáng chế, nhãn hiệu, kiểu dáng công nghiệp, quyền tác giả và các đối tượng sở hữutrí tuệ khác. Trong lĩnh vực sáng chế, TRIPS yêu cầu các quốc gia thành viên phải dành sự bảo hộ và thực thi quyền đối với sáng chế trong tất cả các lĩnh vực công nghệ, trong đó có lĩnh vực dược phẩm. Một trong những cơ chế linh hoạt trong bảo hộ sáng chế dược phẩm theo Hiệp định TRIPS là quy định về li-xăng không tự nguyện (hay còn gọi là li xăng cưỡng bức).
Li-xăng không tự nguyện là việc Chính phủ cho phép một người/công ty khác sản xuất sản phẩm hoặc áp dụng quy trình đã được cấp sáng chế mà không cần sự đồng ý của chủ sở hữu sáng chế dựa trên một số điều kiện và giới hạn cụ thể. Các điều kiện chính liên quan đến cấp li-xăng không tự nguyện bao gồm: (i) chỉ được cấp phép sử dụng nếu trước khi sử dụng người có ý định sử dụng đã cố gắng để được người nắm giữ quyền sáng chế cấp phép với giá cả và các điều kiện thương mại phù hợp, nhưng sau một thời gian hợp lý những cố gắng đó vẫn không đem lại kết quả; (ii) quyền sử dụng này phải là không độc quyền, không chuyển nhượng được; (iii) chỉ được cấp phép sử dụng chủ yếu để cung cấp cho thị trường nội địa của quốc gia thành viên cấp phép; (iv) trong mọi trường hợp, người nắm giữ quyền sáng chế phải được trả tiền đền bù thoả đáng tuỳ theo giá trị kinh tế của quyền sử dụng đã cấp…
Theo điều kiện (iii) nêu trên thì quyền sử dụng chỉ được cấp phép cho mục đích sản xuất để phục vụ thị trường trong nước là chủ yếu. Nghĩa là khi một quốc gia thành viên được cấp quyền không đủ năng lực để sản xuất loại thuốc đó thì thành viên đó không thể hợp tác với các quốc gia thành viên khác để sản xuất. Quy định này vô hình chung đã hạn chế cơ hội tiếp cận thuốc generic giá rẻ của người dân ở các nước đang và kém phát triển.
Để khắc phục bất cập này, các quốc gia thành viên đã thông qua Nghị định thư sửa đổi TRIPS (có hiệu lực từ ngày 23/01/2017).Điều 31bis Nghị định thư sửa đổi TRIPS cho phép các nước thành viên ra quyết định bắt buộc chuyển giao quyền sử dụng đối với một sáng chế dược phẩm mà không cần tuân thủ quy định của Điều 31(f) Hiệp định TRIPS. Điều này có nghĩa là việc cung cấp dược phẩm sản xuất theo quyết định bắt buộc chuyển giao quyền sử dụng đó không chỉ giới hạn ở thị trường nội địa của quốc gia thành viên đó mà còn cho phép xuất khẩu các loại thuốc generic. Ngoài ra, Phụ lục của Nghị định thư sửa đổi TRIPS cũng bổ sung các thuật ngữ như dược phẩm, thành viên nhập khẩu đủ tư cách, thành viên xuất khẩu… để thuận tiện cho việc áp dụng đối với các quốc gia.
Ngày 16/01/2017, Việt Nam đã phê chuẩn Nghị định thư sửa đổi TRIPS. Đồng thời, Chính phủ Việt Nam cũng tuyên bố sử dụng cơ chế được quy định tại Điều 31bis của Nghị định thư sửa đổi TRIPS với tư cách là nước nhập khẩu dược phẩm.
Thực trạng bảo hộ sáng chế dược phẩm tại Việt Nam
Theo số liệu thống kê của Cục SHTT, trong giai đoạn 2000-2016, số văn bằng bảo hộ được cấp cho các sáng chế dược phẩm tại Việt Nam chiếm một tỷ trọng đáng kể trong tổng số văn bằng bảo hộ sở hữu trí tuệ được cấp hàng năm, tuy nhiên số lượng thực tế lại chưa nhiều và tốc độ tăng trưởng qua từng năm hầu như không đáng kể, được thể hiện qua biểu đồ dưới đây:
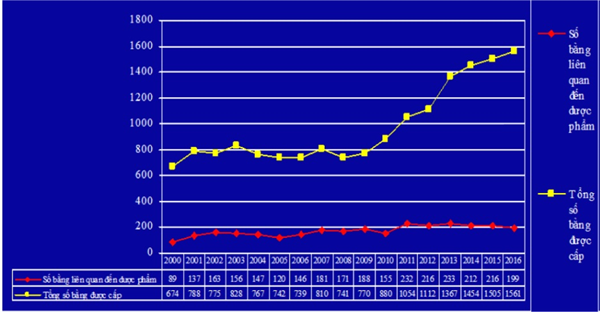
Cũng theo số liệu thống kê của Cục SHTT, các yêu cầu bảo hộ sáng chế về dược phẩm tại Việt Nam chủ yếu tập trung vào các dạng điển hình sau: Bảo hộ dạng Markush; sáng chế lựa chọn; chất đa hình và chất đồng phân đối ảnh; muối, ete và este; chế phẩm, dược phẩm;liều dùng; tổ hợp; tiền dược chất; chất chuyển hóa; ứng dụng mới trong y tế ...
Trong các dạng yêu cầu bảo hộ điển hình nêu trên, kể từ khi Luật SHTT có hiệu lực thi hành (ngày 01/7/2006), sáng chế liên quan đến việc sử dụng nói chung, bao gồm việc sử dụng một sản phẩm đã biết theo chức năng mới lần thứ hai hoặc các lần tiếp theo trong y tế đã bị coi là đối tượng không có khả năng bảo hộ do không phải là sản phẩm hay quy trình và bị từ chối cấp văn bằng bảo hộ.
Trên thực tế, công tác nâng cao chất lượng thẩm định và cấp văn bằng bảo hộ trong lĩnh vực dược phẩm thời gian qua luôn được các cơ quan nhà nước có thẩm quyền chú trọng để tránh tình trạng lạm dụng độc quyền sáng chế. Công tác này cũng chịu giám sát chặt chẽ của các cơ quan có thẩm quyền để ngăn ngừa các hành vi tiêu cực của chủ sở hữu sáng chế. Tuy nhiên, các nội dung liên quan đến sáng chế trong lĩnh vực dược trong Quy chế thẩm định đơn đăng ký sáng chế hiện hành của Cục SHTT vẫn còn khá chung chung, thiếu chi tiết nên rất khó áp dụng. Trong khi đó, hiện tại Cục SHTT vẫn đang trong quá trình nghiêm cứu, dự thảo và xin ý kiến của các cơ quan liên quan để ban hành Quy chế thẩm định độc lập đối với sáng chế dược.





 TH
TH



